L'insuffisance rénale chronique
Qu'est-ce que l'insuffisance rénale chronique ?
Les reins ont une fonction de filtre. Ils éliminent les impuretés que nous accumulons dans notre corps. Parfois, leur fonction est altérée engendrant une accumulation de « déchets » nocifs pour l’organisme notamment le potassium et l’urée dans le sang.
Il est dans ce cas indispensable et même vital de recourir à une épuration extra rénale (hémodialyse).
La clairance de la créatinine est actuellement le meilleur marqueur pour estimer la fonction rénale, en particulier la capacité de filtration des reins et l'excrétion de la créatinine.
Elle est normalement > 100ml /min représentant approximativement 100 % de la fonction rénale. On peut donc considérer qu'un patient qui a 15 ml/min de clairance n'a plus que 15 % de sa fonction rénale et nécessite une hémodialyse.
|
stade 1 2 3 4 5 |
Définition Fonction rénale normale Insuffisance rénale légère Insuffisance rénale modérée Insuffisance rénale sévère Insuffisance rénale terminale |
Clairance de la créatinine (ml/min/1,73 m²) > 90 60-89 30-59 15-29 < 15 |
D’où vient cette maladie et quelle population atteint-elle ?
En France, il y a environ 2 millions de personnes en insuffisance rénale chronique avant le stade terminal. Cela s’explique par le vieillissement de la population dans les pays développés et l’accroissement des pathologies vasculaires, qui se répercutent sur le rein.
L’insuffisance rénale chronique terminale concerne plus de 50 000 personnes en France, soit près de 1‰, dont 60% sont en dialyse et 40% ont bénéficié d’une greffe rénale.
Près d’une fois sur deux, l’insuffisance rénale terminale est secondaire à une hypertension artérielle ou à un diabète, principalement, non insulino-dépendant.
La présence d’un diabète, d’une hypertension artérielle, d’un antécédent de maladie cardiovasculaire, de néphrectomie (ablation d’un rein), d’infections urinaires à répétition ou d’insuffisance rénale dans la famille, doit inciter à rechercher une maladie rénale chronique.
Pourquoi doit-on faire un abord d’hémodialyse ?
La dialyse ou rein artificiel est une méthode d'épuration du sang.
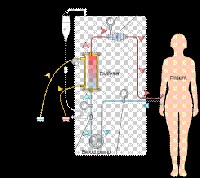
Le dialyseur est en quelque sorte une « machine à filtrer » le sang à l’aide d'un circuit de circulation extra-corporelle (Figure 1). Pour ce faire, il est nécessaire de prélever le sang, de le filtrer, et de le restituer au patient tout cela en circuit fermé à l'aide de tubulures.
On ne peut piquer directement dans le réseau artériel, car en aspirant le sang vers la pompe la tension artérielle chuterait brutalement. On ne peut piquer directement dans le réseau veineux périphérique car ce régime à basse pression ne supporterait pas l'aspiration vers la pompe (veine collabée). Une dialyse efficace requiert un débit sanguin de 300 à 400 ml/min dans le circuit extracorporel, ce qui nécessite un flux d’au moins 400 à 500 ml/min dans l’abord vasculaire de dialyse.
Schématiquement, deux moyens sont actuellement utilisés pour prélever le sang du patient:
- soit par un abord vasculaire veineux central par mise en place d'un cathéter veineux dans une grosse veine près du coeur.
- soit par un abord artérioveineux périphérique (abords natifs= fistule artérioveineuse (FAV) et abords prothétiques ).
Quels sont les différents abords vasculaires d’hémodialyse ?
-
1/ abord vasculaire veineux central
Il est souvent posé en urgence, ou lorsque la fistule artérioveineuse ne fonctionne pas. Il consiste à mettre en place un cathéter dans la veine jugulaire droite. C'est une méthode intéressante dans l'urgence néanmoins il faut préférer la création d'un abord natif. En effet le risque d’infection du cathéter est sept fois plus important, augmentant le taux de mortalité.
2/ abord artérioveineux périphérique natif (fistule artérioveineuse = FAV)
Les fistules artério-veineuses (FAV) natives ont montré leur supériorité, en terme de perméabilité par rapport aux fistules prothétiques (pontages).
Dans deux tiers des cas, l’insuffisance rénale terminale s’installe sur un mode progressif autorisant alors la création d’un abord vasculaire:
L’abord vasculaire doit idéalement être créé dans les 6 à 12 mois précédant le début de l’hémodialyse, lorsque la clairance de créatinine est proche 15 ml/min.
Les objectifs sont:
- d’atteindre un développement optimal de la FAV
- de diagnostiquer et de traiter, si possible, les complications très précoces après l’intervention
- d’éviter le recours aux accès veineux centraux en urgence, générateurs potentiels de thrombose ou sténose du système cave supérieur, pouvant compromettre la création ultérieure d’un abord vasculaire efficace
Le côté non dominant (Bras gauche pour un droitier et inversement) sera choisi préférentiellement pour l’abord vasculaire.
Le site le plus distal sur le membre supérieur (poignet) est préféré.
Un abord distal offre un segment veineux à l’avant bras suffisamment long et superficiel pour permettre des ponctions faciles (avec 2 points de dialyse séparés d’au moins 5 cm), en cas d’échec, un abord plus proximal reste possible.
Il est donc impératif de préserver au maximum le capital de veineux à l'avant-bras.
On préfère la FAV aux cathéters veineux centraux car :
- Meilleure épuration par la FAV
- Taux d’albumine plus élevé
- Anémie mieux contrôlée
- Durée d’utilisation + prolongée
- Moins d’infections
- Moins de thrombose
- Pas de risque de sténose des veines centrales
- Douches et bains possibles
3/ abord artérioveineux périphérique prothétique
Il s’agit d’un pontage entre une artère et une veine.
Quels sont les principaux examens avant la création d'un abord artérioveineux natif d'hémodialyse ?
En premier lieu un examen clinique (Figure 2 ) précis permettra d’orienter très sérieusement la stratégie chirurgicale.
Avant la création du montage vasculaire, un bilan radiologique permet de savoir s’il y a des lésions (sténose, thrombose) artérielles et/ou veineuses significatives et si elles sont accessibles à un traitement préalable.
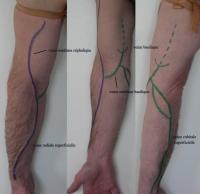
Le site « idéal » pour la création de l’abord peut être ainsi déterminé. Les moyens à disposition sont :
- l’échographie doppler couleur,
- l’angiographie : phlébographie (Figure 3), artériographie, opacification du montage).
Après la création du montage, le bilan radiologique permettra de confirmer une complication clinique suspectée (thrombose, sténose, vol artériel, anévrisme) et éventuellement de la traiter.
